新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说丨捷闻全球医械注册版图再添一笔:瑞士分公司正式成立!

2022-05-27


2022,捷闻的全球布局继续扩充,日前,捷闻瑞士分公司正式成立,作为医械及各产品市场准入的先驱部队,将继续深入的为各位客户、各位朋友带来更“本地化”的服务。
● 目前捷闻Share Info 全球版图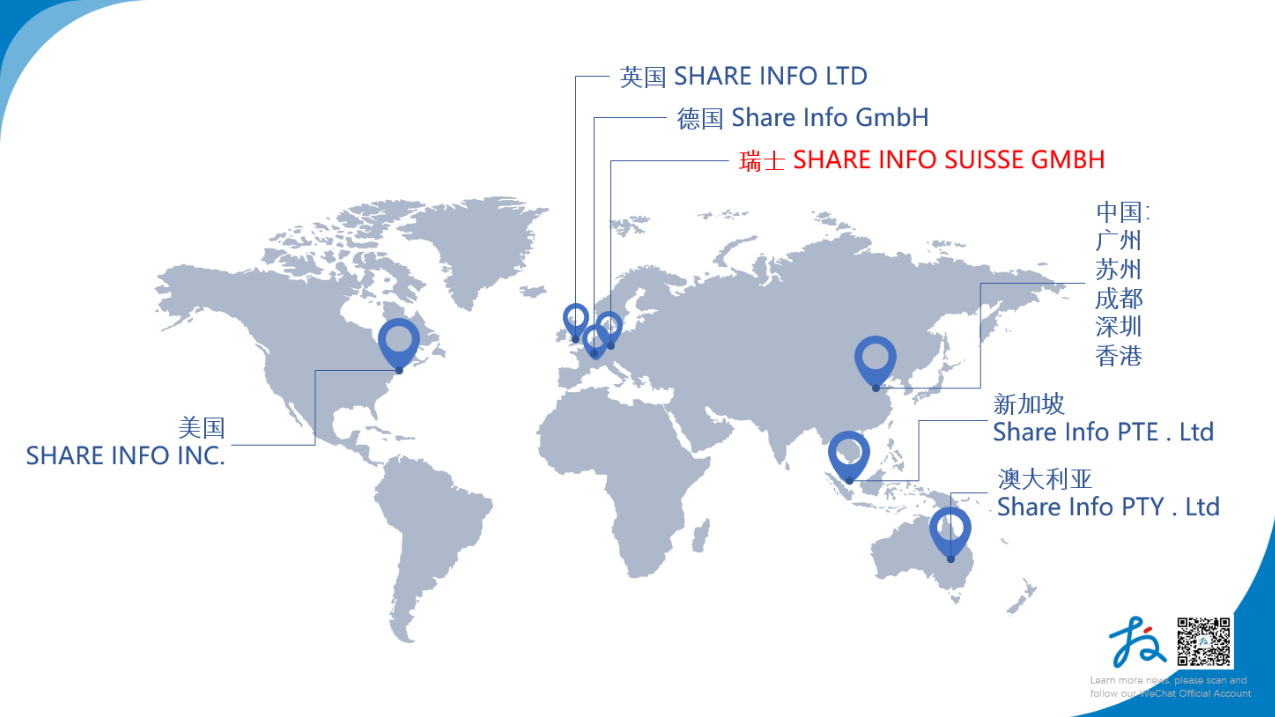
瑞士医疗器械注册法规背景
提起瑞士医疗器械注册,需要先向大家介绍一下他的法规背景。
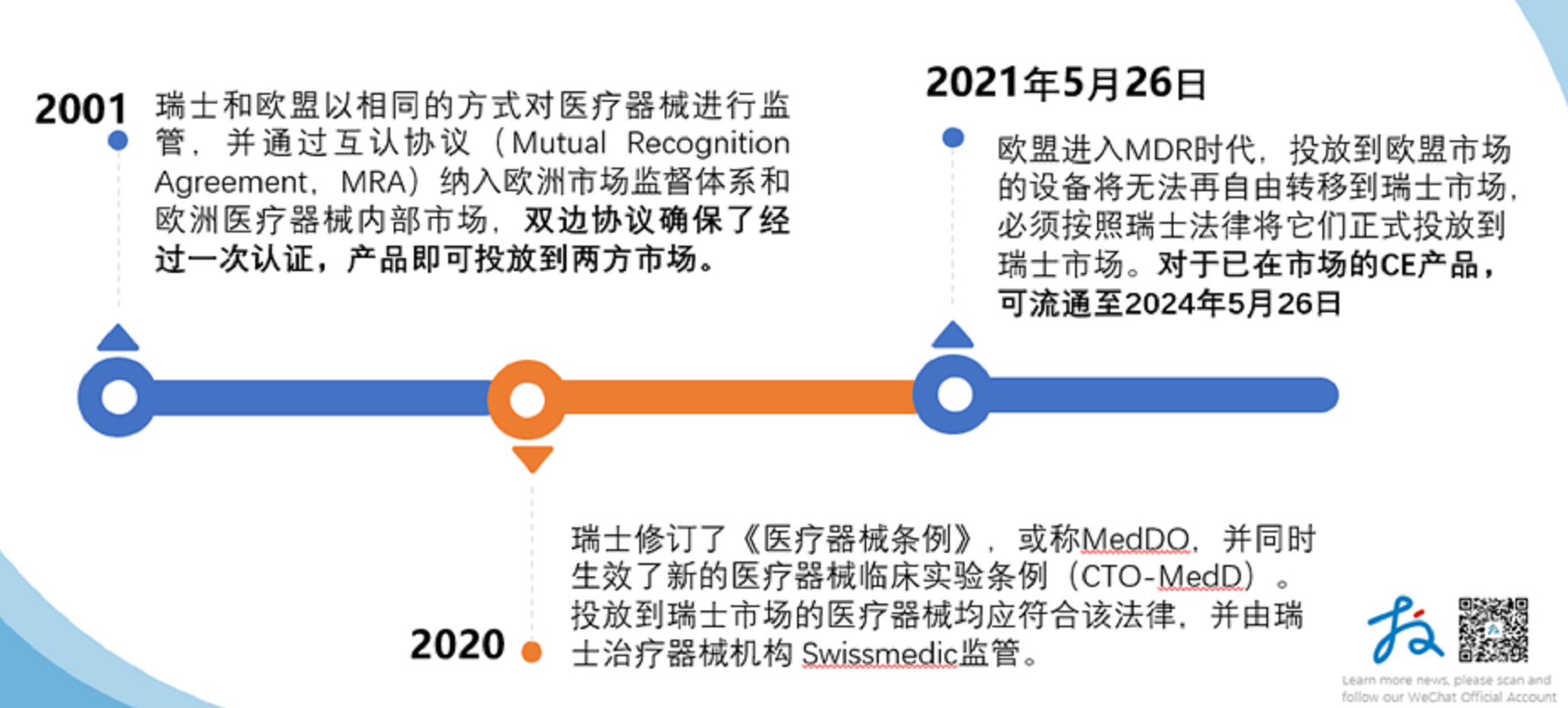
瑞士非欧盟国家,但作为欧洲自由贸易协会会员,自2001年以来,瑞士和欧盟以相同的方式对医疗器械进行监管,并通过互认协议(Mutual Recognition Agreement,MRA)纳入欧洲市场监督体系和欧洲医疗器械内部市场,双边协议确保了经过一次认证,产品即可投放到两方市场。
2020年,瑞士修订了《医疗器械条例》,或称MedDO,并同时生效了新的医疗器械临床实验条例(CTO-MedD)。投放到瑞士市场的医疗器械均应符合该法律,并由瑞士治疗器械机构Swissmedic监管。
2021年5月26日,欧盟进入MDR时代,投放到欧盟市场的设备将无法再自由转移到瑞士市场,必须按照瑞士法律将它们正式投放到瑞士市场。对于已在市场的CE产品,可流通至2024年5月26日。
MedDO仅涵盖瑞士,其中引入了MDR要求,并基于MDR法规要求对医疗器械的定义、上市要求、产品分类,经济运营商的义务及器械监管方式等做出了详细规定。
瑞士医疗器械分类
瑞士医药管理局将医疗器械根据组别和风险分为I、II、III三类。其中I类又分为I, Is和Im,II类又分为IIa和IIb。瑞士制造商(或其AR和进口商)必须在将器械首次投放市场后三个月内在Swissmedic中注册。
瑞士授权代表 Swiss AR
由于法规监管发生变化,非瑞士制造商将必须在过渡期截止日期之前任命瑞士授权代表(Swiss AR)和驻瑞士的进口商:
● 对于III类设备,IIb类可植入设备和有源可植入设备,必须在2021年12月31日之前指定Swiss AR。
● 对于IIb类非植入式设备和IIla类设备,必须在2022年3月31日之前指定Swiss AR。
● 对于I类设备,必须在2022年7月31日之前指定Swiss AR。
其中,几类产品的宽限期已至,大家需要留意一下相关时限。
捷闻Share Info 瑞代
可帮助您:
● 与瑞士医药管理局Swissmedic进行相关沟通;
● 检查您提供的相关资料是否合规,并存档;
● 协助瑞士医药管理局Swissmedic采取所有预防或纠正措施,减少医疗设备造成的风险;
● 负责向瑞士医药管理局Swissmedic报告所辖产品在瑞士发生的严重事件,以及任何调查结果和所采取的纠正措施的细节;
● 警戒趋势报告;



