新闻动态

新捷报,捷闻报 了解最新捷闻咨询
全球医械动态 | 欧盟发布医疗器械制造商的语言要求概述

2024-01-26
原文网址:https://mp.weixin.qq.com/s/DKxv8ALVpMMxyIaGtMbJ7w

近期,欧盟发布了医疗器械制造商的语言要求,其中主要又MDR及IVDR两个表格组成,表格概述了每个会员国的语言要求,旨在帮助医疗器械和体外诊断医疗器械(尤其是中小型医疗器械)的制造商了解特定国家/地区器械随附的信息和说明的语言要求。
MDR的规定和实施MDR的成员国在语言要求方面的规定优先于该表格的信息:

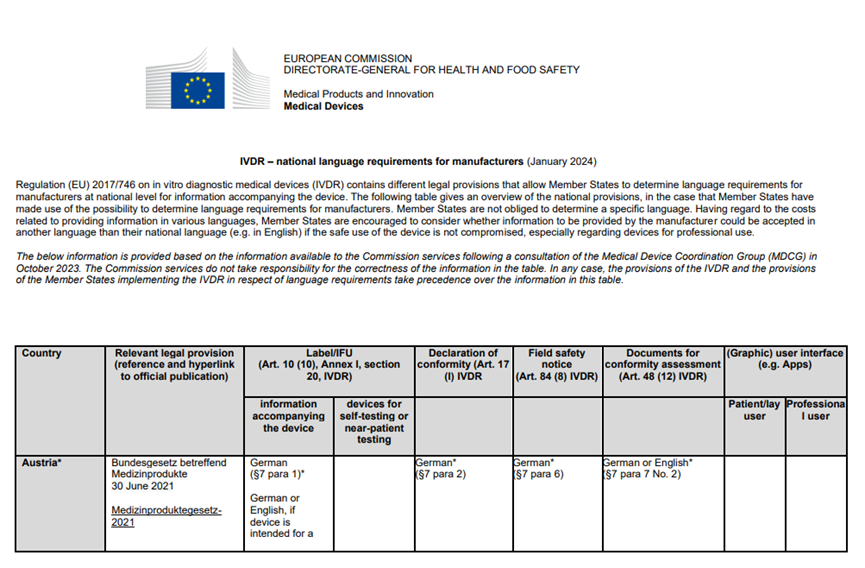
当前表格涵盖的语言要求的国家和地区有:
● 奥地利
● 比利时
● 保加利亚
● 克罗地亚
● 塞浦路斯
● 捷克
● 丹麦
● 爱沙尼亚
● 芬兰
● 法国
● 德国
● 希腊
● 匈牙利
● 爱尔兰
● 意大利
● 拉脱维亚
● 立陶宛
● 卢森堡
● 马耳他
● 荷兰
● 波兰
● 葡萄牙
● 罗马尼亚
● 斯洛伐克
● 斯洛文尼亚
● 西班牙
● 瑞典
● 冰岛
● 列支敦斯登
● 土耳其
● 挪威
涉及到的文件种类有:
● 相关法律规定(参考资料及超连结至官方刊物)
● 标签/IFU
● 自我符合性声明
● 现场安全通知
● 合格评定文件
● (图形)用户界面(例如应用程序)
MDR其他语言要求:关于器械安全性和临床性能摘要(SSCP),第32条MDR,请参阅MDCG-2019-9 Rev.1指南文件,建议SSCP“以一种对预期用户和(如果相关的话)患者清楚的方式编写”(见MDR,附件II(2),第10(11)条)应将SSCP翻译成预期出售该装置的会员国所接受的语文”(第394页)
IVDR其他语言要求:关于设备安全和性能摘要(SSP),第29条IVDR,请参阅MDCG-2022-9模板。
对以上内容有兴趣的朋友可以联系捷闻获取全部表格,
欢迎与我们讨论相关内容!
![]()
联系我们