新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 网络安全+AI医疗:医疗器械注册的下一个“分水岭”已至,如何抢占先机?

2025-04-25
当ChatGPT,Deepseek掀起AI革命,当“万物互联”成为医疗场景的标配,医疗器械的注册审评正以惊人的速度掀起一场前所未有的变革。合规出海必看! 企业如何应对多国监管体系?这一领域既是技术创新的“无人区”,也是法规遵从的“深水区”。
如何破局?捷闻带您深度解析趋势与机遇。
全球监管收紧:网络安全已成“必答题”
近年来,医疗设备因网络安全漏洞导致的召回事件频发,促使各国药监局加速完善监管框架:
1. FDA十年迭代,构建全生命周期防线
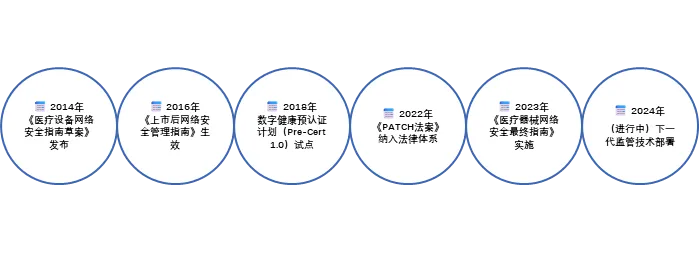
自2014年发布首份网络安全指南以来,FDA不断升级要求:
●2023年最终指南《Cybersecurity in Medical Devices: Quality System Considerations and Content of Premarket Submission》明确:制造商需在产品设计阶段嵌入威胁建模、持续漏洞监测机制,并提供 软件物料清单(SBOM) 以追踪组件风险。
● 2024年草案进一步将网络安全纳入510(k)、De Novo等上市前申请的强制要求,未达标者将被直接拒批。
2. 欧盟MDR法规
将网络安全防护等级与患者风险直接挂钩,要求建立全生命周期数据加密体系
3. 中国NMPA
2022年修订版《医疗器械网络安全注册审查指导原则》强调“全生命周期管理”,要求注册人建立应急响应机制,定期评估漏洞风险。
关键结论:网络安全已从“可选合规项”进阶跃升为“注册准入硬指标”,且需贯穿产品设计、生产、上市后维护全流程。
AI医疗器械:迎来“全生命周期”时代
2025年,全球AI医疗器械市场持续爆发,但各国监管政策也在快速迭代。美国FDA、欧盟CE认证体系等各国相继发布新规,直指AI医疗产品的安全性、透明度与动态监管:
1. 2025年1月,FDA发布《人工智能设备软件功能:生命周期管理及上市提交建议草案》
● 透明与可解释性:
算法需避免“黑箱”,开发者需提交模型卡片(Model Card)[lS1] ,详细说明数据来源、训练方法及潜在偏见。验证数据需覆盖目标人群的多样性,确保不同性别、种族、年龄的适用性。
● 动态风险管理:
采用预定变更控制计划(PCCP),允许上市后在不重新提交申请的情况下优化模型,但变更需预先说明范围(如输入数据调整、模型设计迭代)。
● 持续性能监控:
建立上市后监测机制,实时追踪算法性能衰减或环境变化引发的风险。
● 网络安全与文档规范:
提交材料需涵盖设备描述、用户界面、风险评估、数据管理方案等
● FDA的审批成绩:
• 约80%的AI医疗器械通过证明与已上市产品的“实质等同性”获批,但需提交算法泛化性测试数据。
• De Novo路径崛起:针对无先例的创新AI产品,要求企业提供更严格的临床证据链,平均审评周期缩短至125天。
2. 欧盟通过《医疗器械法规(MDR)》与《人工智能法案(AI Act)[lS2] 》双轨制监管AI医疗器械,高风险产品需通过CE认证+AI法案合规评估
● 分类与临床评价:
按风险等级(I-III类)分类,III类器械需提供临床证据,证明安全有效性。
● 全生命周期追溯:
建立技术文档(Technical Documentation),涵盖设计、开发、验证、生产及退市阶段。上市后需持续监测不良事件,并向通告机构(Notified Body)报告变更计划。
● AI法案附加要求:
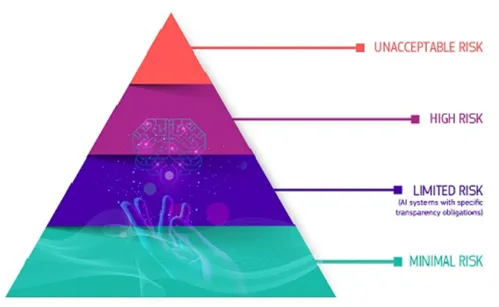
高风险AI系统及以上的风险等级需由欧盟认证机构评估。强调技术透明度,需公开算法决策逻辑及数据使用范围
行业痛点:AI模型的可解释性、数据集标注系统、持续学习导致的版本迭代合规性,成为注册失败的高发区。
企业应对策略:合规破局的三大路径
● 多国协同开发:
参考多国监管的案例,同步构建FDA与MDR技术文档,减少重复成本。
● 动态合规团队:
咨询专职团队,通过专业团队的合规体系建设,跟踪法规更新体制,降低了合规风险。
专业护航,抢占合规先机
面对日益复杂的注册要求,捷闻提供:
* 安全技术文件与合规审计
* 全生命周期风险管理体系搭建
* 多国注册路径规划与快速响应
联系我们
网络安全与AI模型的深度融合,正在重塑医疗器械行业的竞争格局。
唯有拥抱变革、提前布局,方能在这场“合规与技术”的竞速中胜出。
捷闻期待与您携手,共探无限可能!
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!



