新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 印度India医疗器械注册详解:干货闭坑版

2025-04-18
印度的医疗器械注册,主要分几步?
两步。第一步找到捷闻,第二步获证。
~(开个玩笑)
正题开始
根据经验,印度医疗器械注册(这里特指印度CDSCO进口注册),大致可分为8步:
确定印度持证人(印代)→确定注册路径→准备注册资料→产品检测→申请资料的公证及认证→递交申请→获批并取得注册号→进口清关
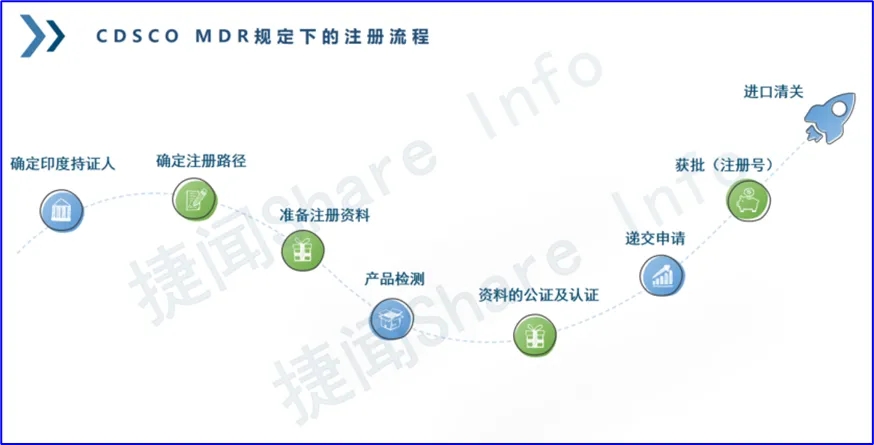
在详细了解印度注册八步法之前,我们需要先对印度进口注册做一个大致的背景介绍。
1. 什么是印度进口注册?
印度境外的制造商(如中国制造商)向印度申请的医疗器械注册,称为进口注册。
2. 进口注册向谁递交申请?
所有类别的进口医疗器械,包括Class A、B、C、D四个风险等级,都直接向印度重要药品标准控制机构(Central Drugs Standard Control Organization,CDSCO)发起申请,由CDSCO的中央许可机构CLA审核发证。印度进口注册,通常也称为CDSCO注册。

3. 进口注册遵循什么法规?
应该遵循印度《印度医疗器械规则2017》(Medical Device Rules,MDR 2017)以及《印度医疗器械规则修订版2020》(Medical Devices (Amendment) Rules 2020)。


4. MDR 2017和MDR修订版2020主要有哪些要求?
在很长一段时间中,印度的医疗器械都是放养式管理。一方面是把医疗器械当做药品管理,另一方面是只有在清单中的医疗器械才强制注册,这个清单被叫做Notified Device(通知产品)。不在Notified Device清单中的产品,是自愿注册,即可直接进入印度。在印度MDR 2017及修订版2020颁布后,印度法规和国际接轨,做了诸多改变:
● 明确医疗器械定义
● 根据产品风险从低到高,医疗器械分为Class A、B、C、D四类
● 从2023年10月起,符合印度MDR医疗器械定义的产品,都需要进行注册

了解完上述背景知识,我们再来逐步解析印度注册八步法的要求。
第一步,确定印度授权代表
印度进口注册,必须要指定一名印度境内的公司作为授权代表,也常称为印代、印度持证人。这位授权代表还必须拥有印度政府颁发的批发商牌照,后续会负责医疗器械的进口和清关。捷闻可提供完善的印度授权代表服务,作为第三方印代,可以让注册的技术细节和印度买家分离,更好保护知识产权。
第二步,确定注册路径
印度注册的产品可大致分为两种,一是印度市场已有类似产品获批,二是印度市场暂无类似产品但全球其他地区有类似产品。以上两种情况,注册要求有差别,对于印度市场暂无类似产品的情况,还需要进行特定专家委员会的临床审核,周期和成本都相对更大。
第三步,准备注册资料
确定好路径之后,需要根据路径要求准备资料。
对于印度已有类似产品的路径,资料大概分为4大块:设备主文档DMF(Device Master File)、工厂主文档PMF(Plant Master File)、测试报告、行政信息(如代理人协议、已获批证书等)。
对于度市场暂无类似产品的路径,除了以上4大块资料,还需要特别准备临床证据,并交给特定委员会审核。
另外,从2022年开始,印度注册需要提供质量管理体系ISO 13485证书。
第四步,产品检测
通常说来,已获得参考国的上市批准,可直接认可参考国的产品测试报告,但需证明参考国测试报告覆盖了印度标准IS的范围。参考国是指:美国、英国、加拿大、欧洲(包括英国/瑞士)、澳大利亚和日本。但要注意以下特殊情况:
- Class D IVD,可能需通过印度国家实验室的补充测试或验证。
- 落入印度标准局 (BIS) 强制清单的产品,需要进行BIS检测和注册。
第五步,注册资料的认证和公证
印度授权代表协议需要进行认证,其他部分注册文档需要进行公证。需要公证的注册文档通常包括设备主文档DMF、工厂主文档PMF、自由销售证书、ISO 13485证书、参考国已获批证书等。
第六步,递交申请
由印代在CDSCO系统上传注册资料并发起注册递交。
第七步,CDSCO审核
此过程中可能会有补充问题,全部发补完成,即可获批。
第八步,获批进口
获批后证书5年有效,可正式进入印度销售。
捷闻总结
印度的各类政策对出海企业来说是一个挑战。但印度市场,确实不能忽视,也有很多中国资本通过日本、新加坡和迪拜等第三国进入印度市场,尽管这增加了不确定性和成本,却能持续参与印度市场。
捷闻,除了能帮助中国制造商获取印度注册,还能协调印度当地经销资源,桥接中印双方的优秀靠谱商业资源。如您有印度准入的需求,欢迎随时联系捷闻。
祝愿所有掘进印度的朋友都能有所收获!
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!



