新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 中、欧、美临床试验要求共同的“三原则”一览

2023-11-10
原文网址:https://mp.weixin.qq.com/s/1jeJgHJ5B1lfnwWzAE-Plg

临床试验作为一大部分医疗器械不可避免的话题,本身就在一个阶段就会存在难度,加之当前国际医疗器械法规环境的不同,各国、地区对其的要求也不同,因此相信大家对此部分还是会有一些疑问。那么本期捷闻就简单以我国、美国、欧盟的共同要求为切入点,带大家梳理一下关于中、欧、美临床法规要求。
医疗器械临床试验是指在经资质认定的医疗器械临床试验机构中,对拟申请注册的医疗器械在正常使用条件下的安全性和有效性进行确认或者验证的过程。
除了免于进行临床评价的产品,开展医疗器械临床评价,可以根据产品特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械的安全性、有效性。
中、欧、美临床试验要求的共同的“三原则”梳理
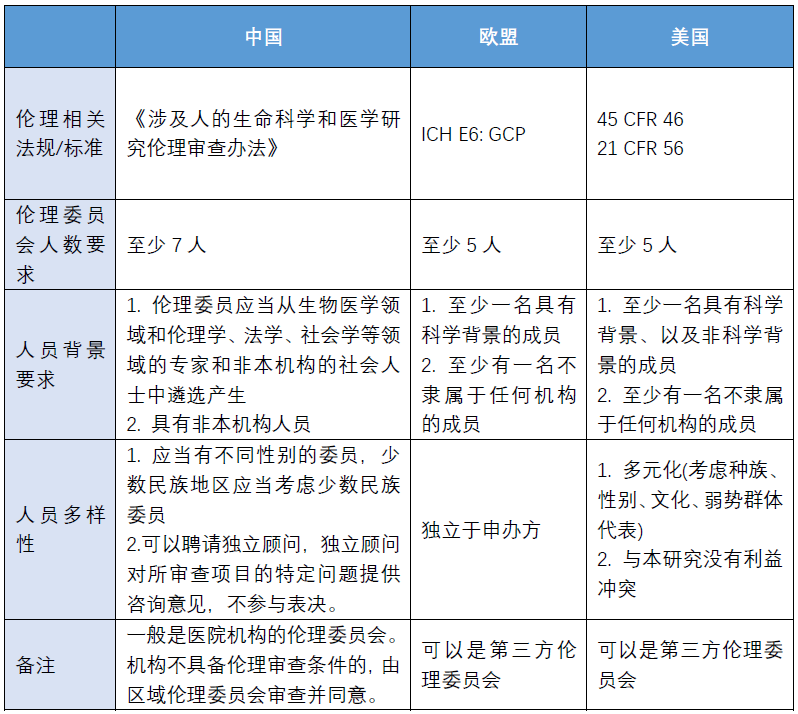
01 伦理原则
这里的伦理原则主要是指临床试验必须遵循《赫尔辛基宣言》确定的伦理原则,以及试验需获得伦理委员会的审批。
《赫尔辛基宣言》(Declaration of Helsinki)制定了涉及人体对象医学研究的道德原则, 是一份包括以人作为受试对象的生物医学研究的伦理原则和限制条件,也是关于人体试验的第二个国际文件,比《纽伦堡法典》更加全面、具体和完善。
它的三个核心理念就是:
-研究方案需要伦理委员会审批
-研究者对受试者医疗负责
-建立受试者知情同意程序
其中我们需要重点关注:试验样本/过程对受试者的风险、知情同意、隐私保护
中欧美的伦理相关规范及标准整理:
02 科学原则
一个好的临床方案必须确保受试者权益的安全性,以及确保临床试验的科学性,这是试验顺利进行、试验过程合规、试验结果正确、试验结论可靠的重要基石。
我们的临床方案也需要基于科学原则,其主要内容需要包括:
1. 临床试验目的
2. 临床试验设计基本类型:平行对照设计、交叉设计、配对设计、单组设计
3. 受试者:入排标准
4. 评价指标:反映医疗器械作用于受试对象而产生的各种效应
5. 比较类型和假设检验
6. 样本量估计
7. 偏倚和随机误差
8. 其他因素:器械的固有特征可能影响其临床试验设计
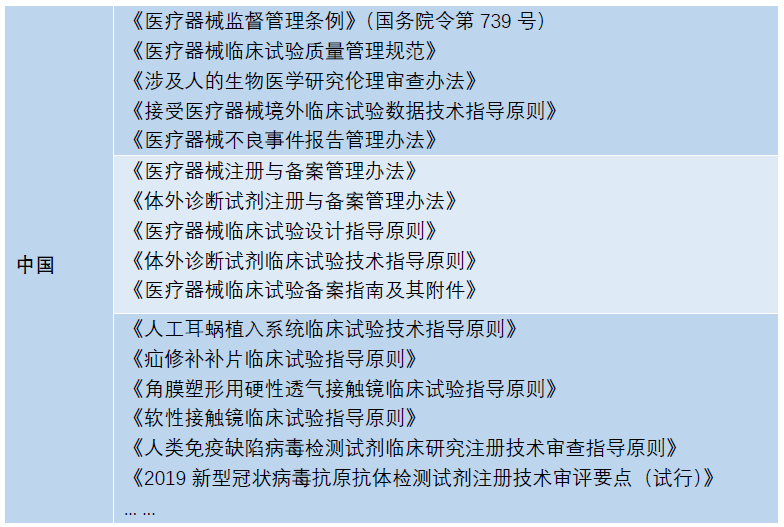
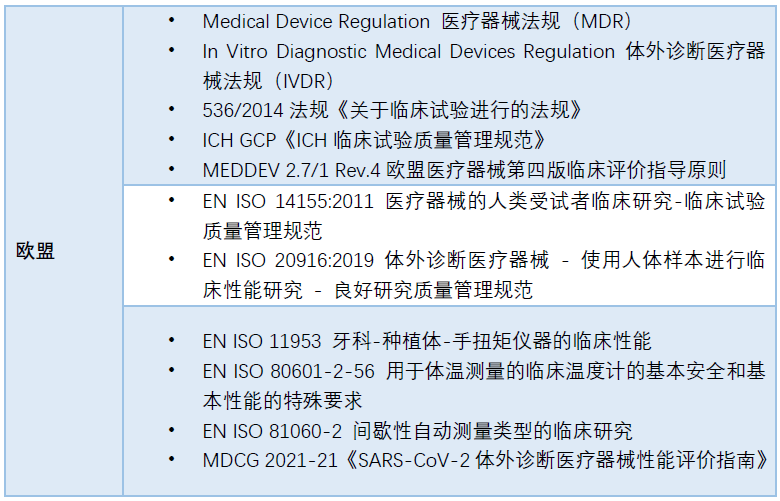
03 依法原则
这里的依法原则即指临床试验需要符合当地法律法规的监管,这里也帮助大家列举了中欧美的临床法规监管状况给大家参考。

End
如果各位朋友对本期内容感兴趣,欢迎联系我们的工作人员!
![]()
联系我们